Es gibt Erkrankungen, deren Pathogenese seit Jahrzehnten bekannt ist. Die eigentliche Ursache für die Krankheit bleibt aber trotz intensiver Forschung ein Geheimnis. Über die membranöse Nephropathie, auch als membranöse Glomerulonephritis bezeichnet, weiß man seit vielen Jahren, dass sich Ablagerungen aus Antigen-Antikörper-Komplexen an der Basalmembran der Niere bilden. Dort lösen sie Entzündungsreaktionen aus und stören die Filterfunktion der Niere. Doch die beteiligten Antikörper und das gebundene Antigen konnten trotz vieler Ansätze viele Jahre nicht identifiziert werden.
Erst 2009 wurde das Geheimnis gelüftet: Der Phospholipase A2 Rezeptor 1 (PLA2R) ist das erste identifizierte Autoantigen, gegen das etwa 70 Prozent der Patienten mit primärer membranöser Nephropathie Autoantikörper bilden. Diese Entdeckung war die Grundlage zur Entwicklung neuer diagnostischer Testsysteme bei EUROIMMUN.
Wichtige Informationen zu Anti-PLA2R und membranöser Nephropathie
- Membranöse Nephropathie ist eine entzündliche Erkrankung der Nieren-Glomeruli und führt zu Proteinurie und Störungen des Fettstoffwechsels bis hin zum möglichen Funktionsverlust der Niere; die Proteinurie dient hierbei als klinischer Marker für die Krankheitsaktivität.
- Die primäre membranöse Nephropathie ist eine nierenspezifische Autoimmunerkrankung; die sekundäre membranöse Nephropathie ist auf eine andere Grunderkrankung zurückzuführen.
- Anti-PLA2R-Autoantikörper sind die bislang einzigen bekannten Biomarker für die primäre membranöse Nephropathie.
- Der Nachweis von Anti-PLA2R-Autoantikörpern ermöglicht eine Differenzierung der primären und sekundären membranösen Nephropathie – eine essentielle Grundlage für die richtige Behandlung.
- Die Bestimmung des Anti-PLA2R-Antikörpertiters erlaubt die Einschätzung von Therapieerfolg und Rückfallrisiko nach einer Nierentransplantation.
Membranöse Nephropathie diagnostizieren
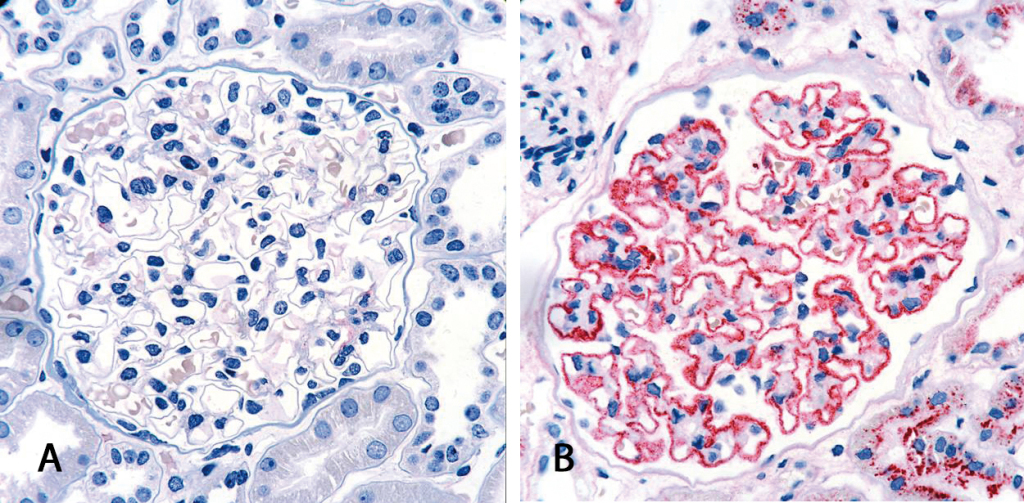
Die Diagnose der membranösen Nephropathie stützt sich zurzeit vor allem auf das Ergebnis einer Nierenbiopsie. Das entnommene Gewebe wird histologisch untersucht und zeigt im Falle eines positiven Befundes Ablagerungen aus Immunkomplexen an der glomerulären Basalmembran. Der invasive Eingriff bedeutet eine körperliche und seelische Belastung für den Patienten. Die Entdeckung von Anti-PLA2R Autoantikörpern als spezifische Biomarker für die primäre membranöse Nephropathie ermöglicht erstmals eine nicht-invasive Form der Diagnostik mit Hilfe einfacher serologischer Tests.
Anti-PLA2R-Tests erleichtern Diagnostik
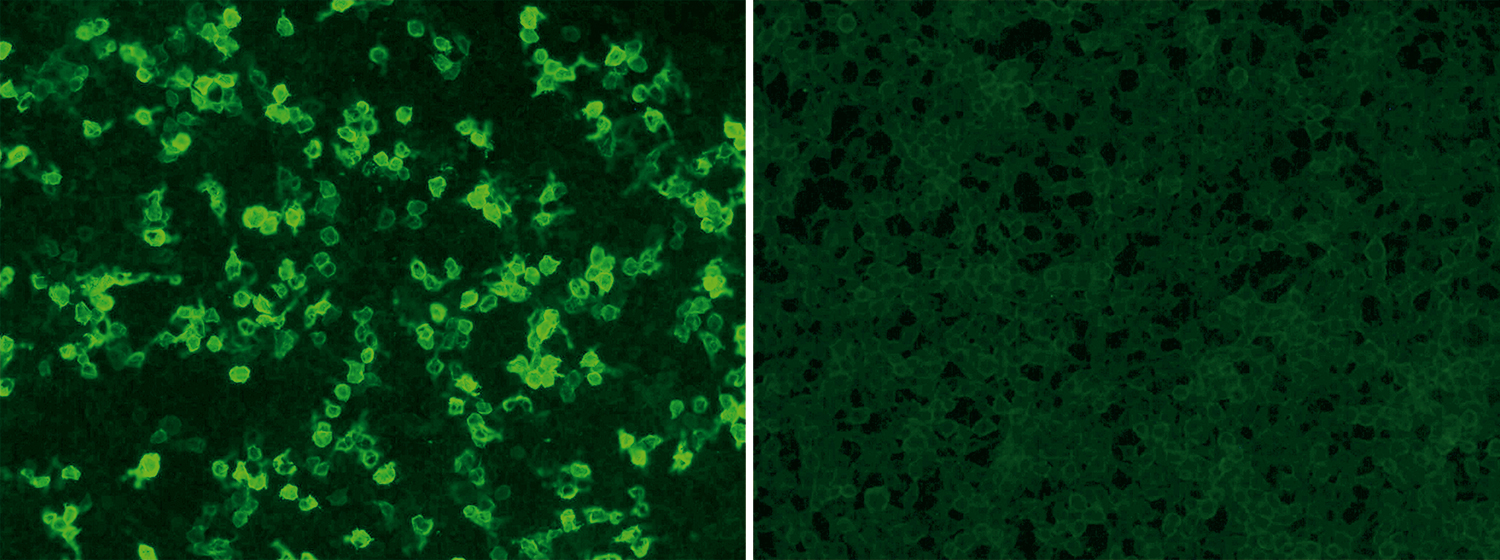
EUROIMMUN bietet standardisierte und kommerziell erhältliche Tests zum qualitativen und quantitativen Nachweis zirkulierender Anti-PLA2R-Autoantikörper an: Der indirekte Immunfluoreszenztest nutzt als Standardsubstrat transfizierte Zellen, die PLA2R auf ihrer Oberfläche exprimieren (siehe Titelbild: positive Reaktion eines Patientenserums mit transfizierten Zellen [links], Kontrollzellen [rechts]; Anti-PLA2R-IIFT (IgG), Bestellnummer: FA 1254-###-50) während für den Enzyme-Linked-Immunoabsorbent-Assay (ELISA) der rekombinant produzierte PLA2R als Antigen zur Beschichtung der ELISA-Platten dient (Anti-PLA2R-ELISA (IgG), Bestellnummer: EA 1254-9601 G). Für beide Tests sind nur wenigen Mengen Blut notwendig, deren Entnahme für die Patienten erheblich weniger belastend ist als eine Biopsie. Beide Tests sind CE-zertifiziert und von der US Food and Drug Administration (FDA) zugelassen.
Der Anti-PLA2R Immunfluoreszenztest
Der Anti-PLA2R-IIFT (IgG) eignet sich zum einfachen und schnellen Screening von Patientenproben mit Verdacht auf membranöse Nephropathie. Autoantikörper gegen PLA2R können mit diesem Test auf verlässliche Weise qualitativ und semi-quantitativ bestimmt werden.
Seit Mai ist der Anti-PLA2R-IIFT (IgG) von der FDA zum Verkauf in den USA genehmigt. Die Zulassung war ein besonderer Erfolg, da es sich um eine De-novo-Zulassung, also die besonders kritische Begutachtung eines neuartigen Testsystems handelte. Der indirekte Immunfluoreszenztest wurde ausdrücklich als hilfreicher Screeningtest für die Diagnose der primären membranösen Nephropathie gelobt. Der Test erlaube es, die primäre membranöse Nephropathie rechtzeitig zu erkennen und entsprechend zu behandeln, erläuterte Alberto Gutierrez, der Direktor der Abteilung für In-vitro-Diagnostik in einer Pressemitteilung der FDA.
Der Anti-PLA2R-ELISA
Der Anti-PLA2R-ELISA (IgG) ist ideal für das Screening großer Probenserien geeignet. Darüber hinaus ermöglicht er die quantitative Bestimmung des Anti-PLA2R-Antikörpertiters zur Überwachung der Krankheitsaktivität.
Wie die Proteinurie korreliert auch der Anti-PLA2R-Antikörpertiter mit der Aktivität der membranösen Nephropathie. Er reagiert jedoch sensibler und schneller auf Veränderungen im Krankheitsverlauf oder auf eine immunsuppressive Behandlung, weshalb der Anti-PLA2R-Titer als Therapiemarker eingesetzt werden kann. Außerdem hat der Anti-PLA2R-Titer einen prädiktiven Wert, da hohe Anti-PLA2R-Antikörpertiter häufig darauf hindeuten, dass eine intensivere und längerfristige Therapie nötig ist, um eine Verbesserung der Symptome zu erzielen. Das Risiko eines Rückfalls der membranösen Nephropathie nach einer Nierentransplantation ist bei hohen Antikörperkonzentrationen erhöht.
Auch dieser Test wurde im Juni 2014 von der FDA genehmigt und wird nun in den USA eingesetzt.